- MANGANÈSE
- MANGANÈSELe manganèse (symbole Mn, numéro atomique 25) est un métal gris clair, brillant comme l’acier, avec des reflets rougeâtres. Il se situe en tête de la colonne VII A de la classification périodique et au centre de la série des éléments dits de transition de la quatrième période, entre le chrome et le fer. Il possède des analogies aussi bien avec les éléments de transition qu’avec ceux de sa propre colonne: technétium et rhénium. En revanche, les analogies avec les éléments du groupe VII B (halogènes) ne sont marquées qu’au degré d’oxydation le plus élevé: ainsi KClO4 et KMn4 sont isomorphes avec des solubilités assez voisines.La configuration électronique externe de l’atome comprend sept électrons: cinq au niveau 3 d et deux au niveau 4 s . Les degrés d’oxydation de zéro à + VII existent, mais, en raison de la configuration externe particulièrement stable (3 d 5) de l’ion Mn2+, la plus grande partie des combinaisons du manganèse présentent cet état de valence.Le manganèse naturel, de masse atomique 54,938, ne comporte qu’un seul isotope stable de masse 55. On connaît des isotopes artificiels radioactifs de masses 50, 51, 52, 54, 56 et 57.Le manganèse est avant tout utilisé comme agent réducteur dans l’élaboration des aciers. La consommation de minerais de manganèse suit donc d’assez près la consommation de l’acier dans le monde, dans un rapport de 5 p. 100 environ de l’acier produit, cette proportion augmentant sans cesse en raison de la fabrication croissante d’aciers spéciaux à haute teneur en manganèse. La production mondiale en minerai de manganèse avait atteint 25 millions en 1976, puis a légèrement diminué. Entre 1985 et 1990, la production oscille entre 23,6 et 25,6 millions de tonnes, elle diminue encore un peu depuis cette époque (20 millions de tonnes en 1993). Depuis plusieurs décennies, des fluctuations se sont produites entre les producteurs: l’ex-U.R.S.S. est en tête avec 6 millions de tonnes devant la Chine (4,2 millions de tonnes), l’Afrique du Sud (2,5 millions de tonnes), l’Australie (1,75 million de tonnes), le Brésil (1,7 million de tonnes), le Gabon (1,5 million de tonnes), le Gh na et le Mexique. Les autres producteurs sont l’Inde, le Maroc, le Japon, le Zaïre et éventuellement les États-Unis. Certains minerais ne sont exploités qu’en cas de crise économique.Élément nécessaire à la vie, le manganèse est un facteur de croissance efficace qui intervient dans la constitution des molécules d’oxydases cellulaires. Aussi entre-t-il dans la composition de divers reconstituants pharmaceutiques et doit-il être présent dans les engrais.1. MétallurgieLa «magnésie noire» (pyrolusite) était connue des Anciens: Pline signale son emploi dans la fabrication du verre. Ce n’est qu’en 1774 que la nature de ce corps noir fut fixée par C. W. Scheele qui identifiait un oxyde d’un métal inconnu, différent du fer, dont l’oxyde Fe34 avait été confondu jusque-là avec la pyrolusite. La même année, T. O. Bergman, sans doute en même temps que J. G. Gahn, collaborateur de C. W. Scheele, préparait pour la première fois, en réduisant la «magnésie noire» par l’huile, quelques régules impurs d’un métal auquel il attribua le nom de magnésium. Ce n’est que plus tard (1785) que L. Guyton de Morveau proposa le nom de manganèse pour éviter toute confusion.Minerais et géochimieLe manganèse est relativement abondant. Sa teneur moyenne dans la croûte terrestre est estimée à 0,1 p. 100, ce qui le classe au douzième rang des éléments chimiques. Trop électropositif, il ne se rencontre jamais à l’état métallique dans la nature.Dans les roches ignées, c’est un élément dispersé qui s’exprime rarement sous une forme minéralogique définie. Toujours divalent, il remplace partiellement les ions de même charge et de rayon ionique voisin dans le réseau cristallin des minéraux de ces roches (amphiboles, pyroxènes, péridots); Il se concentre de préférence dans les silicates de fin de cristallisation du magma (pegmatites), contrairement aux autres éléments de transition. Ces derniers sont en effet stabilisés dans les sites octaédriques de la phase solide en raison de l’effet de champ cristallin, alors que Mn2+, ne subissant pas cet effet (structure 3d 5), s’enrichit, au contraire, dans la phase liquide et ne peut être, en conséquence, entraîné dans le solide que dans la dernière phase de la cristallisation magmatique.Dans les roches sédimentaires, au contraire, le manganèse est souvent présent sous forme de minéraux exprimés. Ses principaux minerais sont d’origine sédimentaire ou volcano-sédimentaire. Ce sont principalement des oxydes de manganèse trivalent ou tétravalent. Ils sont quelquefois assez bien cristallisés: pyrolusite MnO2 quadratique ou ramsdellite Mn2 orthorhombique. Mais il existe de nombreuses variétés mal cristallisées où le manganèse a un degré d’oxydation moyen intermédiaire entre 3 et 4; parmi ces variétés mal cristallisées figurent la birnessite et la todorokite, qui sont les constituants principaux des nodules de manganèse (aussi appelés nodules polymétalliques) que l’on trouve en grande quantité à la surface des fonds marins. Ces nodules constituent la plus grosse réserve mondiale de manganèse; elle est estimée à 1012 tonnes. Toutefois, la rentabilité de leur exploitation n’est pas prouvée. Les nodules présentent une structure en «pelure d’oignon» avec des alternances d’oxyde approximativement tétravalent (la birnessite) et d’un oxyde de degré d’oxydation inférieur, susceptible de contenir des teneurs assez élevées d’autres éléments (Ni, Co, Cu, Pb, etc.), mélangé avec de l’oxyde de fer.On rencontre quelquefois le carbonate MnC3, rarement à l’état pur (rhodocrosite, rose pâle), plus souvent en solution solide dans la calcite CaCO3 ou la dolomite CaMg(CO3)2.Dans l’étude du cycle géochimique du manganèse, la partie la plus intéressante est celle qui concerne son comportement dans l’hydrosphère. Il est dominé par la grande différence de solubilité entre Mn(IV), pratiquement insoluble quel que soit le pH, et Mn(II) assez soluble, à froid du moins, en milieu neutre ou acide. Dans les eaux chargées en oxygène, la forme stable est Mn(IV), mais la transformation du manganèse divalent dissous lors de l’altération des roches cristallines ou des carbonates par l’oxygène de l’air est lente, surtout en milieu neutre ou acide. De ce fait, les eaux de surface peuvent transporter de faibles teneurs de manganèse dissous (2 練 10-7 ion g/l en moyenne), alors que l’eau de mer plus basique, riche en oxygène et dont le temps de résidence est élevé, n’en contient pratiquement pas (10-9 ion g/l). Par contre, les eaux naturelles à caractère réducteur peuvent en contenir beaucoup plus: les eaux interstitielles des vases du fond des mers côtières ont des teneurs pouvant parfois atteindre 10-5 ion g/l, et les sources hydrothermales sous-marines que l’on a découvertes sur la dorsale est-pacifique en contiennent 10-3 ion g/l. Dans les sédiments côtiers et les sédiments lacustres, il peut y avoir ainsi d’énormes gradients de concentration de manganèse dans les eaux interstitielles. Il en résulte (fig. 1) un enrichissement très important de cet élément à l’interface eau-sédiment. C’est ainsi que se forment les nodules des zones côtières et lacustres.Les sources hydrothermales sous-marines constituent le principal apport de manganèse à l’océan. À la sortie de la source, le manganèse se disperse dans l’océan; comme la réaction d’oxydation qui le transformera en Mn2 insoluble est lente, il pourra se déposer assez loin des dorsales.Le dosage du manganèse dans les eaux des fonds océaniques, dosage qui peut être effectué à bord d’un navire océanographique, permet la localisation des sources hydrothermales; c’est ainsi qu’ont été repérées les sources à 130 de latitude nord sur la dorsale est-pacifique.Extraction du métal. AlliagesAutrefois, 90 p. 100 de la production du minerai était destinée à la fabrication de l’acier, et 10 p. 100 environ à la fabrication de composés: MnO2 naturel ou synthétique comme dipolarisant des piles, les permanganates comme Mn4K pour le traitement, mais aussi MnS4 introduit dans l’alimentation du bétail et certains composés utilisés comme fongicides.Pour être rentable, le minerai doit atteindre un taux supérieur à 12 p. 100, mais les périodes de crise conduisent à traiter des minerais plus pauvres (aux Indes et aux États-Unis, par exemple, pendant la guerre de Corée). Le traitement courant, en Afrique du Sud, est un enrichissement en liqueur dense, suivi d’une électrolyse en milieu sulfurique (le métal titre 99,9 p. 100). La cathode est en acier au chrome-nickel-molybdène, résistant à l’électrolyte MnS4, dans lequel on fait barboter un courant de S2 pour éviter l’électrolyse et l’oxydation du sel manganeux. Le compartiment anodique, séparé par un diaphragme, contient le sel manganeux à un pH voisin de 1 et l’anode en plomb allié. En fin d’opération, le manganèse métallique est détaché de la cathode par martelage et se présente sous forme de paillettes.Pour les minerais pauvres, après enrichissement, le traitement de réduction s’effectue par le coke, l’huile, CO, 2, etc. Mn2 est transformé en MnO, qui est repris par des acides; le fer est précipité par l’ammoniaque, C2+ et Ni2+ par les ions S2-; les ions Mn2+ de la solution sont transformés en MnO par oxydation anodique. Le métal s’obtient alors par aluminothermie de Mn34 provenant de la réduction par chauffage de Mn2:
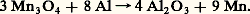 Depuis 1970, on s’intéresse à l’exploitation des nodules marins, plus riches en manganèse qu’en autres métaux stratégiques. Les procédés envisagés relèvent soit de l’hydrométallurgie, soit de la pyrométallurgie, de façon analogue à ceux que nous venons de décrire. Cependant, le problème de la récupération des nodules, qui relève pour la France du C.E.A. et de l’Ifremer, n’est pas encore décidé du fait de son prix de revient. C’est pour diminuer ce prix de revient que l’on envisagera peut-être de récupérer le manganèse qui constitue 25 p. 100 des nodules. On risque alors un marché excédentaire pour ce métal.À une certaine époque, on a envisagé la possibilité d’obtenir du métal pur par distillation sous vide d’alliages Fe-Mn (Ugine et université de Grenoble). Le principe était d’utiliser la forte tension de vapeur du manganèse. Il semble que les conditions économiques ont fait mettre en sommeil ce procédé.Autrefois, la plus grande partie du minerai produit était utilisée sous forme de spiegels (Fe-Mn-C, avec 30 p. 100 en masse environ de manganèse). Ces spiegels étaient utilisés en fin d’opération dans les fours Martin (pratiquement disparus) pour désoxyder, désulfurer et recarburer l’acier. On utilise maintenant des ferromanganèses (de 30 à 80 p. 100 de manganèse obtenu en réduisant le minerai par le coke en présence d’oxydes de fer dans les fours électriques).Les ferromanganèses servent à la fabrication d’aciers spéciaux dans lesquels le manganèse stabilise la forme austénitique 塚 de structure cubique à faces centrées. Cette propriété est discutée dans le cas des aciers inoxydables à 18 p. 100 de chrome et 10 p. 100 de nickel. D’autre part, en présence de carbone, lorsqu’il y a formation de cérimentite Fe3C, le manganèse peut se substituer au fer pour former (Fe, Mn)3C. Les premiers aciers utilisés à 13-14 p. 100 de manganèse et environ 1 p. 100 de carbone sont les aciers Hadfield . Outre les aiguillages de chemin de fer, on retrouve les aciers au manganèse dans les broyeurs à boulets, les plaques de blindage, etc. Ils sont souvent alliés au chrome et au nickel. Plus récemment, des aciers Fe-Mn-Cr, Fe-Mn-Al avec ou sans carbone ont été développés. Certaines nuances trouvent des applications cryogéniques (développées par les Japonais avec des petits tonnages).2. PropriétésCaractéristiques physiquesLe manganèse existe sous quatre formes allotropiques 見, 廓, 塚 et 嗀 dont les températures de transformation réversibles sont:
Depuis 1970, on s’intéresse à l’exploitation des nodules marins, plus riches en manganèse qu’en autres métaux stratégiques. Les procédés envisagés relèvent soit de l’hydrométallurgie, soit de la pyrométallurgie, de façon analogue à ceux que nous venons de décrire. Cependant, le problème de la récupération des nodules, qui relève pour la France du C.E.A. et de l’Ifremer, n’est pas encore décidé du fait de son prix de revient. C’est pour diminuer ce prix de revient que l’on envisagera peut-être de récupérer le manganèse qui constitue 25 p. 100 des nodules. On risque alors un marché excédentaire pour ce métal.À une certaine époque, on a envisagé la possibilité d’obtenir du métal pur par distillation sous vide d’alliages Fe-Mn (Ugine et université de Grenoble). Le principe était d’utiliser la forte tension de vapeur du manganèse. Il semble que les conditions économiques ont fait mettre en sommeil ce procédé.Autrefois, la plus grande partie du minerai produit était utilisée sous forme de spiegels (Fe-Mn-C, avec 30 p. 100 en masse environ de manganèse). Ces spiegels étaient utilisés en fin d’opération dans les fours Martin (pratiquement disparus) pour désoxyder, désulfurer et recarburer l’acier. On utilise maintenant des ferromanganèses (de 30 à 80 p. 100 de manganèse obtenu en réduisant le minerai par le coke en présence d’oxydes de fer dans les fours électriques).Les ferromanganèses servent à la fabrication d’aciers spéciaux dans lesquels le manganèse stabilise la forme austénitique 塚 de structure cubique à faces centrées. Cette propriété est discutée dans le cas des aciers inoxydables à 18 p. 100 de chrome et 10 p. 100 de nickel. D’autre part, en présence de carbone, lorsqu’il y a formation de cérimentite Fe3C, le manganèse peut se substituer au fer pour former (Fe, Mn)3C. Les premiers aciers utilisés à 13-14 p. 100 de manganèse et environ 1 p. 100 de carbone sont les aciers Hadfield . Outre les aiguillages de chemin de fer, on retrouve les aciers au manganèse dans les broyeurs à boulets, les plaques de blindage, etc. Ils sont souvent alliés au chrome et au nickel. Plus récemment, des aciers Fe-Mn-Cr, Fe-Mn-Al avec ou sans carbone ont été développés. Certaines nuances trouvent des applications cryogéniques (développées par les Japonais avec des petits tonnages).2. PropriétésCaractéristiques physiquesLe manganèse existe sous quatre formes allotropiques 見, 廓, 塚 et 嗀 dont les températures de transformation réversibles sont: La phase 塚 se forme au cours du dépôt électrolytique du manganèse et se transforme rapidement en la phase 見, stable à température ordinaire.La couche électronique d , à moitié remplie, du manganèse est responsable de l’anomalie systématique des constantes physiques et mécaniques de cet élément par rapport à celles des autres éléments de transition de la quatrième période de la classification. Ces constantes, relatives à la variété 見, sont consignées dans le tableau 1.Propriétés chimiquesLe tableau 2 indique quelques réactions du manganèse. La chimie, en solution aqueuse, du manganèse et de ses combinaisons à ses divers degrés d’oxydation peut être prévue à l’aide du diagramme potentiel E = f (pH) de la figure 2. Ce diagramme a été calculé à partir des valeurs thermodynamiques des potentiels normaux d’oxydoréduction du tableau 1. Le manganèse y apparaît avec les degrés d’oxydation 0 (métal), II (composés manganeux), III (composés manganiques), IV (bioxyde), VI (manganates) et VII (permanganates).On peut constater sur ce diagramme que:– Le métal Mn(0) est très réducteur: il sera attaqué par l’eau (lentement à froid) et par les acides dilués selon la réaction 1, puisque son domaine de stabilité est situé au-dessous de celui de l’eau dont la limite inférieure est indiquée par la ligne a du diagramme. A fortiori, il réagira sur l’oxygène dont le potentiel normal est encore plus élevé (ligne b ), mais, contrairement aux métaux qui le précèdent dans la quatrième période, le manganèse n’est pas protégé par une couche d’oxyde.– À pH 礪 8 et E 麗 0, les ions Mn2+ sont précipités à l’état d’hydroxyde Mn(OH)2 incolore, qui est oxydé sous forme de Mn34, Mn23 ou Mn2 bruns et noirs, selon la force de l’oxydant antagoniste. La première de ces réactions est du type 2. Ce brunissement de Mn(OH)2 est à la base du contrôle de l’oxygène dans les gaz.– Le dioxyde Mn2 peu soluble se dissout en milieu acide en présence de réducteur selon la réaction 3:
La phase 塚 se forme au cours du dépôt électrolytique du manganèse et se transforme rapidement en la phase 見, stable à température ordinaire.La couche électronique d , à moitié remplie, du manganèse est responsable de l’anomalie systématique des constantes physiques et mécaniques de cet élément par rapport à celles des autres éléments de transition de la quatrième période de la classification. Ces constantes, relatives à la variété 見, sont consignées dans le tableau 1.Propriétés chimiquesLe tableau 2 indique quelques réactions du manganèse. La chimie, en solution aqueuse, du manganèse et de ses combinaisons à ses divers degrés d’oxydation peut être prévue à l’aide du diagramme potentiel E = f (pH) de la figure 2. Ce diagramme a été calculé à partir des valeurs thermodynamiques des potentiels normaux d’oxydoréduction du tableau 1. Le manganèse y apparaît avec les degrés d’oxydation 0 (métal), II (composés manganeux), III (composés manganiques), IV (bioxyde), VI (manganates) et VII (permanganates).On peut constater sur ce diagramme que:– Le métal Mn(0) est très réducteur: il sera attaqué par l’eau (lentement à froid) et par les acides dilués selon la réaction 1, puisque son domaine de stabilité est situé au-dessous de celui de l’eau dont la limite inférieure est indiquée par la ligne a du diagramme. A fortiori, il réagira sur l’oxygène dont le potentiel normal est encore plus élevé (ligne b ), mais, contrairement aux métaux qui le précèdent dans la quatrième période, le manganèse n’est pas protégé par une couche d’oxyde.– À pH 礪 8 et E 麗 0, les ions Mn2+ sont précipités à l’état d’hydroxyde Mn(OH)2 incolore, qui est oxydé sous forme de Mn34, Mn23 ou Mn2 bruns et noirs, selon la force de l’oxydant antagoniste. La première de ces réactions est du type 2. Ce brunissement de Mn(OH)2 est à la base du contrôle de l’oxygène dans les gaz.– Le dioxyde Mn2 peu soluble se dissout en milieu acide en présence de réducteur selon la réaction 3: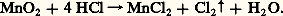 Inversement, Mn2+ est oxydé en Mn2 en présence d’un oxydant dont le potentiel du couple redox est supérieur à 1,23 à pH = 0 et à 0,1 à pH = 14.– Le potentiel normal du couple Mn3+/Mn2+ (équation 4) étant supérieur à celui du couple Mn4+/Mn2+ (équation 3), les ions Mn3+ sont instables en solution et se dismutent suivant:
Inversement, Mn2+ est oxydé en Mn2 en présence d’un oxydant dont le potentiel du couple redox est supérieur à 1,23 à pH = 0 et à 0,1 à pH = 14.– Le potentiel normal du couple Mn3+/Mn2+ (équation 4) étant supérieur à celui du couple Mn4+/Mn2+ (équation 3), les ions Mn3+ sont instables en solution et se dismutent suivant: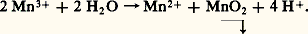 – À pH 礪 13, Mn2 s’oxyde en manganate vert en présence d’oxydants énergiques (E 礪 0,6 à pH = 13), selon l’équilibre 7. En milieu acide, Mn42- se dismute suivant la réaction 8:
– À pH 礪 13, Mn2 s’oxyde en manganate vert en présence d’oxydants énergiques (E 礪 0,6 à pH = 13), selon l’équilibre 7. En milieu acide, Mn42- se dismute suivant la réaction 8: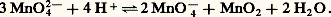 Ce fait est à la base des liqueurs dites «caméléon minéral»: vert 燎 violet. – L’ion permanganate Mn4-, violet, est un oxydant puissant aussi bien en milieu acide (réaction 5) qu’en milieu alcalin (réaction 6). Théoriquement, Mn4- devrait oxyder l’eau (ligne b ) avec dégagement d’oxygène; mais, en milieu neutre et à l’abri de la lumière, la vitesse de cette réaction est pratiquement nulle, d’où l’utilisation des solutions de permanganate dans les dosages redox (manganimétrie).Données analytiquesLa meilleure méthode de caractérisation qualitative consiste à oxyder, en milieu nitrique, les ions Mn2+ par le persulfate d’ammonium en présence d’ions Ag+ jouant le rôle de catalyseur. On peut aussi oxyder par le périodate de potassium sans catalyseur. En chauffant un peu, on obtient la coloration violette caractéristique des ions Mn4-. La réaction est spécifique et sensible (limite de sensibilité: 3 ppm).Le dosage du manganèse s’effectue suivant le même principe: oxydation, en milieu nitrique, de Mn2+ en Mn4- par le persulfate en présence d’ions Ag+, ou, mieux, par le bismuthate de sodium sans catalyseur. Mn4- est alors dosé soit par volumétrie à l’aide d’une solution titrée de sulfate ferreux jusqu’à décoloration du permanganate, ou bien en présence d’un indicateur tel que l’orthophénanthroline ferreuse si la solution à doser est trop diluée, soit encore par colorimétrie de l’ion Mn4- à 530 猪m. Cette dernière méthode est la meilleure au point de vue de la sensibilité et de la précision.On peut aussi doser par polarographie: dans une solution de base de triéthanolamine, à pH = 13, il y a formation d’un complexe vert bouteille de Mn3+, dont le potentiel de demi-vague, situé à 漣 0,40 V [cf. POLAROGRAPHIE], permet un dosage précis du manganèse en présence des autres métaux, le fer en particulier. Seul le cuivre est gênant.Dans certains cas, lorsque le manganèse a pu être séparé à l’état de bioxyde, on peut calciner ce dernier à 900 0C et peser l’oxyde Mn34 formé.3. ComposésTous les degrés d’oxydation du manganèse, de zéro à + VII, sont connus. On trouvera, dans le tableau 3, quelques exemples de composés simples ou complexes ou d’oxyanions, ainsi que leur structure en relation avec le nombre de coordination du manganèse dans ces composés.D’une manière générale, le caractère acide de ces cations croît avec l’augmentation du degré d’oxydation (diminution du rayon et augmentation de la charge de l’ion). Ainsi, Mn(OH)2 est une base assez forte, Mn2 est amphotère et HMn4 est un acide fort.Signalons l’existence de trois degrés d’oxydation très instables: 漣 I dans [Mn(CO)5]-, ainsi que 漣 II et 漣 III, qui correspondent à des composés extrêmement réducteurs.Degré d’oxydation + IILe degré d’oxydation + II est le plus stable du manganèse, plus difficile à oxyder que Cr2+ et Fe2+ (grande stabilité de la structure électronique 3d 5). Il existe dans un très grand nombre de composés.Les sels manganeux sont roses en solution et à l’état cristallisé. On les obtient par attaque acide du métal. Peu réducteurs (le potentiel normal du couple Mn3+/Mn2+ est très élevé), ils se conservent bien à l’air. Ils sont paramagnétiques (5 électrons d célibataires). Citons: l’oxyde MnO, l’hydroxyde Mn(OH)2, peu soluble, qui s’oxyde à l’air en brunissant, les halogénures MnX2 plus ou moins hydratés, le sulfate [Mn(H2O)6,S4], H2O, isomorphe du sel ferreux correspondant, le carbonate MnC3, peu soluble, isomorphe de la calcite, le sulfure MnS, peu soluble.Les complexes manganeux sont moins stables que ceux de Fe2+ et Cr2+. Ce phénomène est dû au rayon ionique plus élevé de Mn2+, à son caractère acide moins fort et à l’énergie de stabilisation nulle par effet de champ de coordinats (structure 3d 5), sauf dans quelques complexes à spin faible. Ces complexes présentent un paramagnétisme correspondant à 5 électrons célibataires dans le cas où le champ électrique du coordinat est faible. C’est le cas du complexe [Mn(H2O)6]2+.En revanche, pour des coordinats à champ fort, tel C-, le paramagnétisme du complexe n’est plus compatible qu’avec un seul électron célibataire par suite de transposition et modification du cortège électronique superficiel. C’est le cas de [Mn(CN)6]4-.Les ions -, Cl-, SC-, P43-, C242- ainsi que NH3 forment aussi des complexes peu stables avec Mn2+.L’énergie de stabilisation par effet de champ de coordinat étant plus élevée pour MnI et MnIII que pour MnII, il s’ensuit que les complexes manganeux pourront être facilement réduits ou oxydés (cf. réactions ci-dessous).Degré d’oxydation + IIITous les dérivés de MnIII sont fortement colorés, peu stables et très oxydants. En solution aqueuse, ils ne peuvent exister et sont réduits avec dégagement d’oxygène. Dans les acides, ils se dismutent:
Ce fait est à la base des liqueurs dites «caméléon minéral»: vert 燎 violet. – L’ion permanganate Mn4-, violet, est un oxydant puissant aussi bien en milieu acide (réaction 5) qu’en milieu alcalin (réaction 6). Théoriquement, Mn4- devrait oxyder l’eau (ligne b ) avec dégagement d’oxygène; mais, en milieu neutre et à l’abri de la lumière, la vitesse de cette réaction est pratiquement nulle, d’où l’utilisation des solutions de permanganate dans les dosages redox (manganimétrie).Données analytiquesLa meilleure méthode de caractérisation qualitative consiste à oxyder, en milieu nitrique, les ions Mn2+ par le persulfate d’ammonium en présence d’ions Ag+ jouant le rôle de catalyseur. On peut aussi oxyder par le périodate de potassium sans catalyseur. En chauffant un peu, on obtient la coloration violette caractéristique des ions Mn4-. La réaction est spécifique et sensible (limite de sensibilité: 3 ppm).Le dosage du manganèse s’effectue suivant le même principe: oxydation, en milieu nitrique, de Mn2+ en Mn4- par le persulfate en présence d’ions Ag+, ou, mieux, par le bismuthate de sodium sans catalyseur. Mn4- est alors dosé soit par volumétrie à l’aide d’une solution titrée de sulfate ferreux jusqu’à décoloration du permanganate, ou bien en présence d’un indicateur tel que l’orthophénanthroline ferreuse si la solution à doser est trop diluée, soit encore par colorimétrie de l’ion Mn4- à 530 猪m. Cette dernière méthode est la meilleure au point de vue de la sensibilité et de la précision.On peut aussi doser par polarographie: dans une solution de base de triéthanolamine, à pH = 13, il y a formation d’un complexe vert bouteille de Mn3+, dont le potentiel de demi-vague, situé à 漣 0,40 V [cf. POLAROGRAPHIE], permet un dosage précis du manganèse en présence des autres métaux, le fer en particulier. Seul le cuivre est gênant.Dans certains cas, lorsque le manganèse a pu être séparé à l’état de bioxyde, on peut calciner ce dernier à 900 0C et peser l’oxyde Mn34 formé.3. ComposésTous les degrés d’oxydation du manganèse, de zéro à + VII, sont connus. On trouvera, dans le tableau 3, quelques exemples de composés simples ou complexes ou d’oxyanions, ainsi que leur structure en relation avec le nombre de coordination du manganèse dans ces composés.D’une manière générale, le caractère acide de ces cations croît avec l’augmentation du degré d’oxydation (diminution du rayon et augmentation de la charge de l’ion). Ainsi, Mn(OH)2 est une base assez forte, Mn2 est amphotère et HMn4 est un acide fort.Signalons l’existence de trois degrés d’oxydation très instables: 漣 I dans [Mn(CO)5]-, ainsi que 漣 II et 漣 III, qui correspondent à des composés extrêmement réducteurs.Degré d’oxydation + IILe degré d’oxydation + II est le plus stable du manganèse, plus difficile à oxyder que Cr2+ et Fe2+ (grande stabilité de la structure électronique 3d 5). Il existe dans un très grand nombre de composés.Les sels manganeux sont roses en solution et à l’état cristallisé. On les obtient par attaque acide du métal. Peu réducteurs (le potentiel normal du couple Mn3+/Mn2+ est très élevé), ils se conservent bien à l’air. Ils sont paramagnétiques (5 électrons d célibataires). Citons: l’oxyde MnO, l’hydroxyde Mn(OH)2, peu soluble, qui s’oxyde à l’air en brunissant, les halogénures MnX2 plus ou moins hydratés, le sulfate [Mn(H2O)6,S4], H2O, isomorphe du sel ferreux correspondant, le carbonate MnC3, peu soluble, isomorphe de la calcite, le sulfure MnS, peu soluble.Les complexes manganeux sont moins stables que ceux de Fe2+ et Cr2+. Ce phénomène est dû au rayon ionique plus élevé de Mn2+, à son caractère acide moins fort et à l’énergie de stabilisation nulle par effet de champ de coordinats (structure 3d 5), sauf dans quelques complexes à spin faible. Ces complexes présentent un paramagnétisme correspondant à 5 électrons célibataires dans le cas où le champ électrique du coordinat est faible. C’est le cas du complexe [Mn(H2O)6]2+.En revanche, pour des coordinats à champ fort, tel C-, le paramagnétisme du complexe n’est plus compatible qu’avec un seul électron célibataire par suite de transposition et modification du cortège électronique superficiel. C’est le cas de [Mn(CN)6]4-.Les ions -, Cl-, SC-, P43-, C242- ainsi que NH3 forment aussi des complexes peu stables avec Mn2+.L’énergie de stabilisation par effet de champ de coordinat étant plus élevée pour MnI et MnIII que pour MnII, il s’ensuit que les complexes manganeux pourront être facilement réduits ou oxydés (cf. réactions ci-dessous).Degré d’oxydation + IIITous les dérivés de MnIII sont fortement colorés, peu stables et très oxydants. En solution aqueuse, ils ne peuvent exister et sont réduits avec dégagement d’oxygène. Dans les acides, ils se dismutent: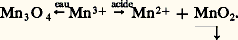 Les composés de MnIII ne peuvent donc exister qu’à l’état anhydre. Citons: Mn23, Mn3, Mn2(SO4)3.On connaît de nombreux complexes et chélates stables avec l’acétylacétone [MnA3]0 noir, la triéthanolamine [MnT(OH)4]- vert bouteille, les malonates et oxalates [Mn(C24)3]3- pourpres, les cyanures [Mn(CN)6]3- rouges, dont le sel de potassium est isomorphe du ferricyanure, les fluorures [Mn6]3- rouges, etc. Ils sont tous paramagnétiques, avec un moment correspondant à deux ou à quatre électrons célibataires selon la force du champ de coordinat.Degré d’oxydation + IVDans l’état d’oxydation + IV, seul le dioxyde Mn2 noir est important. Oxyde très peu soluble (Ks = 10-56), il est légèrement amphotère. Ainsi, dans la soude 10 N, il se comporte comme un acide très faible et forme un manganite peu soluble Na2Mn3; c’est aussi une base très faible, mais le cation, Mn4+, trop acide, ne peut exister dans l’eau. On a préparé quelques sels anhydres, MnCl4, Mn(SO4)2, par exemple, et quelques complexes stables et paramagnétiques:
Les composés de MnIII ne peuvent donc exister qu’à l’état anhydre. Citons: Mn23, Mn3, Mn2(SO4)3.On connaît de nombreux complexes et chélates stables avec l’acétylacétone [MnA3]0 noir, la triéthanolamine [MnT(OH)4]- vert bouteille, les malonates et oxalates [Mn(C24)3]3- pourpres, les cyanures [Mn(CN)6]3- rouges, dont le sel de potassium est isomorphe du ferricyanure, les fluorures [Mn6]3- rouges, etc. Ils sont tous paramagnétiques, avec un moment correspondant à deux ou à quatre électrons célibataires selon la force du champ de coordinat.Degré d’oxydation + IVDans l’état d’oxydation + IV, seul le dioxyde Mn2 noir est important. Oxyde très peu soluble (Ks = 10-56), il est légèrement amphotère. Ainsi, dans la soude 10 N, il se comporte comme un acide très faible et forme un manganite peu soluble Na2Mn3; c’est aussi une base très faible, mais le cation, Mn4+, trop acide, ne peut exister dans l’eau. On a préparé quelques sels anhydres, MnCl4, Mn(SO4)2, par exemple, et quelques complexes stables et paramagnétiques: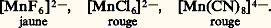 Mn2 est aussi un oxydant. C’est à ce titre qu’il est utilisé comme dépolarisant cathodique des piles sèches du type Leclanché et qu’il réagit sur HCl (découverte du chlore, Carl Wilhelm Scheele, 1774).Très divisé, Mn2 possède un pouvoir adsorbant important, vis-à-vis de K+ et de Ba2+ en particulier [cf. GÉOCHIMIE], et des propriétés de catalyseur d’oxydation: décomposition de H22 ou de KCl3 (préparation de l’oxygène). Son activité varie avec la nature des variétés allotropiques: pyrolusite quadratique, ramsdellite orthorhombique, psilomélane et cryptomélane monocliniques. Toutes ces variétés sont paramagnétiques.Degré d’oxydation + VL’ion hypomanganate Mn43-, bleu intense, semble être le seul représentant de cet état d’oxydation. La réduction du permanganate par le sulfite de sodium en milieu très alcalin fournit une solution bleue d’où cristallise le sel: Na3Mn4,10H2O. Très instable, Mn43- n’existe qu’en solution très alcaline et se dismute, par dilution, en Mn42- vert et Mn2 précipité.Degré d’oxydation + VIPar fusion alcaline oxydante (KOH + KCl3) d’un sel manganeux ou du bioxyde, on obtient l’ion manganate (MnO42-) de couleur verte, seul représentant connu de cet état d’oxydation. L’ion Mn42- n’est stable qu’en solution alcaline et se dismute par dilution ou acidification en Mn2 et Mn4- (réaction 8). C’est un oxydant énergique (réaction 7). Ses sels alcalins sont isomorphes des sulfates et chromates. Leur moment magnétique correspond à un électron célibataire au niveau d .Degré d’oxydation + VIIL’ion permanganate Mn4-, violet intense, est obtenu par oxydation des manganates en milieu alcalin, soit par les hypochlorites, soit par électrolyse:
Mn2 est aussi un oxydant. C’est à ce titre qu’il est utilisé comme dépolarisant cathodique des piles sèches du type Leclanché et qu’il réagit sur HCl (découverte du chlore, Carl Wilhelm Scheele, 1774).Très divisé, Mn2 possède un pouvoir adsorbant important, vis-à-vis de K+ et de Ba2+ en particulier [cf. GÉOCHIMIE], et des propriétés de catalyseur d’oxydation: décomposition de H22 ou de KCl3 (préparation de l’oxygène). Son activité varie avec la nature des variétés allotropiques: pyrolusite quadratique, ramsdellite orthorhombique, psilomélane et cryptomélane monocliniques. Toutes ces variétés sont paramagnétiques.Degré d’oxydation + VL’ion hypomanganate Mn43-, bleu intense, semble être le seul représentant de cet état d’oxydation. La réduction du permanganate par le sulfite de sodium en milieu très alcalin fournit une solution bleue d’où cristallise le sel: Na3Mn4,10H2O. Très instable, Mn43- n’existe qu’en solution très alcaline et se dismute, par dilution, en Mn42- vert et Mn2 précipité.Degré d’oxydation + VIPar fusion alcaline oxydante (KOH + KCl3) d’un sel manganeux ou du bioxyde, on obtient l’ion manganate (MnO42-) de couleur verte, seul représentant connu de cet état d’oxydation. L’ion Mn42- n’est stable qu’en solution alcaline et se dismute par dilution ou acidification en Mn2 et Mn4- (réaction 8). C’est un oxydant énergique (réaction 7). Ses sels alcalins sont isomorphes des sulfates et chromates. Leur moment magnétique correspond à un électron célibataire au niveau d .Degré d’oxydation + VIIL’ion permanganate Mn4-, violet intense, est obtenu par oxydation des manganates en milieu alcalin, soit par les hypochlorites, soit par électrolyse: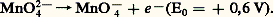 Les permanganates de nombreux métaux sont connus. On les prépare, le plus souvent, par double décomposition entre Ba(MnO4)2 et leurs sulfates, ou bien entre AgMn4 et leurs chlorures.Ils sont très utilisés comme agents oxydants de la chimie préparative et analytique. Les réducteurs les font passer à l’état + II en solution acide (réaction 5), et à l’état + IV en solution alcaline (réaction 6).L’acide correspondant HMn4 est connu en solution. Acide fort, ses sels des métaux alcalins ne subissent donc pas l’hydrolyse. On connaît aussi l’anhydride Mn27, obtenu par déshydratation de HMn4 avec l’acide sulfurique concentré. C’est un liquide huileux, vert olive, explosif.Quoique ne possédant pas d’électrons célibataires, l’ion Mn4- présente cependant un faible paramagnétisme. Ses sels sont isomorphes des perchlorates, ce qui conduit à attribuer au manganèse une structure électronique sp 3 (tétraédrique), identique à celle du chlore dans l’ion Cl4-. Cette structure s’accorde aussi avec le fait que KMn4 donne une solution solide avec BaS4. La précipitation de BaS4 en présence d’ions Mn4- constitue, d’ailleurs, une réaction analytique spécifique du baryum, réaction fondée sur le fait que les cristaux mixtes roses formés ne sont pas décolorés par les réducteurs usuels.4. UsagesLe manganèse sert non seulement à préparer des aciers alliés de dureté élevée, mais aussi à désoxyder, à désulfurer et à recarburer les aciers dans le haut fourneau. Cependant, cette utilisation est en régression et le manganèse sert surtout maintenant à augmenter la limite d’élasticité des aciers. Néanmoins, tout acier industriel faiblement ou fortement allié contient au moins 1 p. 100 de manganèse.Parmi les alliages non ferreux, il faut noter que 5 p. 100 de cuivre fournit un alliage ductile alors que le métal est cassant. En jouant sur les compositions et les traitements thermiques, on a élaboré des alliages à haute capacité d’amortissement utilisés pour la lutte contre les vibrations et contre le bruit. Citons les alliages Sonoston (54 p. 100 Mn, 4,28 p. 100 Al, 1,5 p. 100 Ni, 3 p. 100 Fe) et Incramute (Cu, 40 p. 100, Mn, 2 p. 100, Al). Frapper une cloche en un tel alliage ne produit aucun bruit. D’autres alliages à base de cuivre et à teneur élevée en manganèse et en nickel sont également utilisés. Cependant, les espoirs mis dans les alliages manganèse-cuivre, ou manganèse-nickel, même en présence d’autres éléments d’alliages, n’ont pas encore donné lieu au développement industriel que l’on pouvait en attendre. On a développé un acier inoxydable au manganèse (alliages Mn-Cu) avec effet de mémoire. Il faut également citer les alliages magnétiques comme Fe-Mn-Al avec des teneurs variables en carbone. Ces alliages peu onéreux pourront concurrencer les alliages magnétiques contenant du nickel et du cobalt, mais il faut encore attendre pour s’assurer de leur impact industriel. On retrouve des alliages contenant du manganèse dans les résistances électriques (avec de l’aluminium et du carbone) et dans les bilames (avec du cuivre et du nickel), etc.Parmi les applications des sels et oxydes de manganèse, on peut citer les pigments pour peinture à l’huile et teinture des tissus. C’est le cas de Mn2 (bistre de manganèse ou terre d’ambre ), de MnCuO4 (jaune), de MnCO3 (blanc de manganèse), du complexe phosphorique de MnII (violet de manganèse ), de la solution solide de sulfate et de manganate de baryum (bleu de manganèse ) et du vert de Cassel (BaMnO4).Les sels manganeux sont des catalyseurs d’oxydation qui assurent le durcissement de l’huile de lin et des peintures usuelles (siccatif). On utilise le borate et surtout des sels d’acides organiques naturels: résinates, linoénates et naphténates.Les oxydes de manganèse servent aussi, selon leur proportion, soit à décolorer, soit à colorer les verres. Ainsi, la couleur verte du verre usuel, due à la présence d’oxyde FeO et Fe23, peut être supprimée par addition de quantités convenables de Mn2 qui oxyde FeO en Fe23, le mélange MnO-Fe23 étant très peu coloré. Au contraire, l’addition de quantités plus importantes donne aux verres des couleurs jaune pâle (MnO), rougeâtre (MnO2), rose à brun (mélange MnO-Mn2). Citons encore l’utilisation de MnS4 dans l’alimentation du bétail, de certains sels de manganèse comme fongicides et de Mn4K qui redevient important pour le traitement des eaux.Dans la lutte contre la corrosion du fer et des aciers, on utilise des immersions à 90 0C dans le phosphate Mn(H2P4): les pièces se recouvrent d’une couche de Fe3(PO4)2 qui les protège contre la rouille. Cependant, parmi les sels de manganèse utilisés industriellement, le dioxyde de manganèse Mn2 utilisé comme dépolarisant des piles sèches représente 90 p. 100 du marché des composés du manganèse. On sait que les piles de type Leclanché se composent d’une anode de zinc et d’une cathode en charbon, l’électrolyte étant NH4C. Les propriétés oxydantes de Mn2 provoquent à la cathode:
Les permanganates de nombreux métaux sont connus. On les prépare, le plus souvent, par double décomposition entre Ba(MnO4)2 et leurs sulfates, ou bien entre AgMn4 et leurs chlorures.Ils sont très utilisés comme agents oxydants de la chimie préparative et analytique. Les réducteurs les font passer à l’état + II en solution acide (réaction 5), et à l’état + IV en solution alcaline (réaction 6).L’acide correspondant HMn4 est connu en solution. Acide fort, ses sels des métaux alcalins ne subissent donc pas l’hydrolyse. On connaît aussi l’anhydride Mn27, obtenu par déshydratation de HMn4 avec l’acide sulfurique concentré. C’est un liquide huileux, vert olive, explosif.Quoique ne possédant pas d’électrons célibataires, l’ion Mn4- présente cependant un faible paramagnétisme. Ses sels sont isomorphes des perchlorates, ce qui conduit à attribuer au manganèse une structure électronique sp 3 (tétraédrique), identique à celle du chlore dans l’ion Cl4-. Cette structure s’accorde aussi avec le fait que KMn4 donne une solution solide avec BaS4. La précipitation de BaS4 en présence d’ions Mn4- constitue, d’ailleurs, une réaction analytique spécifique du baryum, réaction fondée sur le fait que les cristaux mixtes roses formés ne sont pas décolorés par les réducteurs usuels.4. UsagesLe manganèse sert non seulement à préparer des aciers alliés de dureté élevée, mais aussi à désoxyder, à désulfurer et à recarburer les aciers dans le haut fourneau. Cependant, cette utilisation est en régression et le manganèse sert surtout maintenant à augmenter la limite d’élasticité des aciers. Néanmoins, tout acier industriel faiblement ou fortement allié contient au moins 1 p. 100 de manganèse.Parmi les alliages non ferreux, il faut noter que 5 p. 100 de cuivre fournit un alliage ductile alors que le métal est cassant. En jouant sur les compositions et les traitements thermiques, on a élaboré des alliages à haute capacité d’amortissement utilisés pour la lutte contre les vibrations et contre le bruit. Citons les alliages Sonoston (54 p. 100 Mn, 4,28 p. 100 Al, 1,5 p. 100 Ni, 3 p. 100 Fe) et Incramute (Cu, 40 p. 100, Mn, 2 p. 100, Al). Frapper une cloche en un tel alliage ne produit aucun bruit. D’autres alliages à base de cuivre et à teneur élevée en manganèse et en nickel sont également utilisés. Cependant, les espoirs mis dans les alliages manganèse-cuivre, ou manganèse-nickel, même en présence d’autres éléments d’alliages, n’ont pas encore donné lieu au développement industriel que l’on pouvait en attendre. On a développé un acier inoxydable au manganèse (alliages Mn-Cu) avec effet de mémoire. Il faut également citer les alliages magnétiques comme Fe-Mn-Al avec des teneurs variables en carbone. Ces alliages peu onéreux pourront concurrencer les alliages magnétiques contenant du nickel et du cobalt, mais il faut encore attendre pour s’assurer de leur impact industriel. On retrouve des alliages contenant du manganèse dans les résistances électriques (avec de l’aluminium et du carbone) et dans les bilames (avec du cuivre et du nickel), etc.Parmi les applications des sels et oxydes de manganèse, on peut citer les pigments pour peinture à l’huile et teinture des tissus. C’est le cas de Mn2 (bistre de manganèse ou terre d’ambre ), de MnCuO4 (jaune), de MnCO3 (blanc de manganèse), du complexe phosphorique de MnII (violet de manganèse ), de la solution solide de sulfate et de manganate de baryum (bleu de manganèse ) et du vert de Cassel (BaMnO4).Les sels manganeux sont des catalyseurs d’oxydation qui assurent le durcissement de l’huile de lin et des peintures usuelles (siccatif). On utilise le borate et surtout des sels d’acides organiques naturels: résinates, linoénates et naphténates.Les oxydes de manganèse servent aussi, selon leur proportion, soit à décolorer, soit à colorer les verres. Ainsi, la couleur verte du verre usuel, due à la présence d’oxyde FeO et Fe23, peut être supprimée par addition de quantités convenables de Mn2 qui oxyde FeO en Fe23, le mélange MnO-Fe23 étant très peu coloré. Au contraire, l’addition de quantités plus importantes donne aux verres des couleurs jaune pâle (MnO), rougeâtre (MnO2), rose à brun (mélange MnO-Mn2). Citons encore l’utilisation de MnS4 dans l’alimentation du bétail, de certains sels de manganèse comme fongicides et de Mn4K qui redevient important pour le traitement des eaux.Dans la lutte contre la corrosion du fer et des aciers, on utilise des immersions à 90 0C dans le phosphate Mn(H2P4): les pièces se recouvrent d’une couche de Fe3(PO4)2 qui les protège contre la rouille. Cependant, parmi les sels de manganèse utilisés industriellement, le dioxyde de manganèse Mn2 utilisé comme dépolarisant des piles sèches représente 90 p. 100 du marché des composés du manganèse. On sait que les piles de type Leclanché se composent d’une anode de zinc et d’une cathode en charbon, l’électrolyte étant NH4C. Les propriétés oxydantes de Mn2 provoquent à la cathode: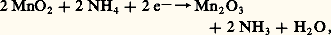 et à l’anode:
et à l’anode: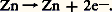 Les qualités dépolarisantes de Mn2 dépendent grandement de la variété allotropique utilisée. Les dioxydes de manganèse naturel (NMD) sont concurrencés par des qualités de dioxydes améliorées obtenues par voie synthétique (EMD, dioxyde électrochimique et CMD, dioxyde chimique). La fabrication du dioxyde pour pile est importante puisque la consommation annuelle mondiale est supérieure à 200 000 tonnes.
Les qualités dépolarisantes de Mn2 dépendent grandement de la variété allotropique utilisée. Les dioxydes de manganèse naturel (NMD) sont concurrencés par des qualités de dioxydes améliorées obtenues par voie synthétique (EMD, dioxyde électrochimique et CMD, dioxyde chimique). La fabrication du dioxyde pour pile est importante puisque la consommation annuelle mondiale est supérieure à 200 000 tonnes.
manganèse [ mɑ̃ganɛz ] n. m.• 1774; « magnésie noire » 1578, a. nom du peroxyde de manganèse; it. manganesa, p.-ê. altér. de magnesia♦ Chim. Élément atomique de transition (Mn; no at. 25; m. at. 54,93), métal gris clair, dur et cassant, employé sous forme d'alliages. Sulfure de manganèse. ⇒ alabandite. Acier, bronze au manganèse (⇒ spiegel) .
● manganèse nom masculin (italien manganese) Métal du groupe des métaux de transition, très employé sous forme d'alliages. (Élément de symbole Mn.) Numéro atomique : 25 Masse atomique : 54,938 Masse volumique : 7,43 g°cm3 Température de fusion : 1 244 °Cmanganèsen. m. CHIM élément métallique (symbole Mn) de numéro atomique Z = 25.— Métal (Mn) gris. Le manganèse entre dans la composition d'alliages avec le fer.⇒MANGANÈSE, subst. masc.CHIM., MINÉR. Métal gris, dur, cassant, très oxydable, de numéro atomique 25, de masse atomique 54,93 (symb. Mn). Minerais de manganèse; oxydes et hydroxydes de manganèse; carbure, chlorure, iodure de manganèse; carbonate, citrate, lactate, sulfate de manganèse. L'acier au manganèse, caractérisé par sa dureté et sa résistance à l'abrasion (P. ROUSSEAU, Hist. techn. et invent., 1967, p. 303). V. acerdèse ex. 1 et 3:• ♦ Très voisin du fer par les propriétés et les caractères généraux de ses combinaisons, le manganèse est extrêmement répandu dans la nature minérale et organisée (...). On le trouve parmi les constituants minéraux des plantes (...) et, en petite quantité chez les animaux, par exemple dans le sang des mammifères. Dans la matière minérale, le manganèse est surtout présent à l'état d'oxydes.M. GÉLOSO, J. FAUCHERRE ds Nouv. traité de chim. minérale, Paris, Masson, t. 16, 1960, p. 693.— P. méton. Minerai, oxyde, sel de manganèse. Les célèbres amas de pegmatite de Chanteloube, au milieu desquels se rencontrent, avec l'émeraude, des manganèses phosphatés divers, et de nombreux minéraux tenant du niobium et du tantale (ÉLIE DE BEAUMONT, Stratigraphie, 1869, p. 556). Violet de manganèse, phosphate de manganèse (OVIO, Vision coul., 1932, p. 141). Tu entends Ferdinand?... Des haricots? Dans un terrain sans manganèse! Et pourquoi pas des petits pois? (CÉLINE, Mort à crédit, 1936, p. 579).REM. 1. Manganate, subst. masc., chim., minér. Chacun des sels dérivés de l'anhydride manganique MnO3. Le manganate de potassium est d'un vert très foncé; on l'appelle encore caméléon minéral ou caméléon vert (CHALON, Explosifs mod., 1911, p. 39). 2. Manganeux, -euse, adj., chim., minér. [En parlant d'un composé du manganèse bivalent (oxyde MnO et sels correspondants); en parlant de l'anhydride MnO2 et de l'acide correspondant] Le carbonate manganeux est une poudre blanc rosé (LEBEAU, COURTOIS, Pharm. chim., t. 1, 1929, p. 336). Il est important de constater que les sels manganiques avec ion n sont solubles dans l'eau, tandis que les combinaisons manganeuses plus riches en oxygène sont presque insolubles (VERNADSKY, Géochim., 1924, p. 101). 3. Manganine, subst. fém. Alliage contenant 84 % de cuivre, 12 % de manganèse, 4 % de nickel, très résistant aux différences de température et utilisé pour cela comme résistance électrique. Le maillechort peut être utilisé [pour le rhéostat des cuves d'électrolyses], mais les alliages connus sous le nom de constantan [alliage de cuivre et de nickel] et de manganine lui sont incontestablement supérieurs (GASNIER, Dépôts métall., 1927, p. 310). 4. Manganique, adj. a) Chim., minér. [En parlant d'un composé du manganèse trivalent (sesquioxyde Mn2O3 et sels correspondants); en parlant de l'anhydride MnO3 et de l'acide correspondant] Acide manganique. Ce composé n'est pas encore connu à l'état de liberté. On obtient des combinaisons de l'acide manganique avec les bases par la calcination du bioxyde de manganèse avec la potasse, la soude, la baryte ou les azotates de ces oxydes (M. MOISSAN ds Encyclop. chim., Paris, Dunod, t. 3, 1886, p. 69). La braunite a une formule correspondant à Mn2O3. Cependant ce n'est pas l'oxyde Mn2O3, dont nous avons parlé. C'est un sel manganique de l'acide H2MnO3 dont l'anhydride est MnO2. Sa formule est Mn MnO3 (VERNADSKY, Géochim., 1924 p. 81). V. acerdèse ex. 2. b) Qui se rapporte au manganèse; en partic., qui a pour cause l'absorption ou l'inhalation du manganèse ou de l'un de ses composés. On observe fréquemment, chez les sujets exposés à l'inhalation répétée de poussières de dioxyde de manganèse (...), une pneumonie manganique (Méd. Biol. t. 2 1971, s.v. manganisme). 5. Manganisme, subst. masc., méd. Intoxication due au manganèse, ou à l'un de ses composés, en général d'origine professionnelle, caractérisée par une atteinte pulmonaire et une atteinte du système nerveux central. L'intoxication subaiguë [au manganèse] expose à la constitution d'une pneumopathie fibreuse; surtout l'intoxication chronique est responsable d'une maladie professionnelle avec trouble du comportement et syndrome extrapyramidal. En quelques mois se constitue un syndrome parkinsonien (démarche hésitante et spasmodique, incoordination motrice, faciès figé, tremblement). Bien des symptômes peuvent disparaître après cessation de l'exposition. Ailleurs, le manganisme persiste toute la vie (J.-P. FRÉJAVILLE, C. BISMUTH, F. CONSO, Toxicologie clinique, Paris, Flammarion, 1971, p. 397). 6. Manganite1, subst. masc., chim. Chacun des sels dérivés de l'anhydride manganeux MnO2. Manganite de Zinc [5(MnO2)ZnO]. Ce corps est brun rouge foncé, on distingue dans la masse un grand nombre de cristaux trop petits pour être mesurés. Les dosages du manganèse et du zinc conduisent à la formule ci-dessus (M. MOISSAN ds Encyclop. chim., Paris, Dunod, t. 3, 1886, p. 67). 7. Manganite2, subst. fém., chim., minér. Synon. de acerdèse. 8. Manganosite, subst. fém., chim., minér. L'oxyde manganeux anhydre naturel constitue la manganosite. Ce minerai se trouve à l'état microcristallin; sa dureté est comprise entre 5 et 6. Le poids spécifique est 5,18 (M. GÉLOSO, J. FAUCHERRE ds Nouv. traité de chim. minérale, Paris, Masson, t. 16, 1960 p. 749).Prononc. et Orth.:[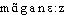 ]. Att. ds Ac. 1762. Étymol. et Hist. 1. 1578 «peroxyde de manganèse, ou magnésie noire» (VIGENÈRE, Tabl. de Philostrate, f° 241 r° ds GDF. Compl.); 2. 1787 «métal gris, dur, cassant» (Tableau de la nomenclature chimique, n°34). Empr. à l'ital. manganese, att. au sens 1 dep. 1301-1303 (Statuto della gabella di Siena ds BATT.), d'orig. inc.; BL.-W.1-5, EWFS2, COR. et COR.-PASC. y voient une altération du lat. médiév. magnesia (magnésie) alors que DEI et BATT. proposent un gr. byz.
]. Att. ds Ac. 1762. Étymol. et Hist. 1. 1578 «peroxyde de manganèse, ou magnésie noire» (VIGENÈRE, Tabl. de Philostrate, f° 241 r° ds GDF. Compl.); 2. 1787 «métal gris, dur, cassant» (Tableau de la nomenclature chimique, n°34). Empr. à l'ital. manganese, att. au sens 1 dep. 1301-1303 (Statuto della gabella di Siena ds BATT.), d'orig. inc.; BL.-W.1-5, EWFS2, COR. et COR.-PASC. y voient une altération du lat. médiév. magnesia (magnésie) alors que DEI et BATT. proposent un gr. byz.  , mais ces formes ne conviennent pas du point de vue phonét. (v. FEW t.6, 1, p.198a).DÉR. 1. Manganésé, -ée, adj. [En parlant d'un minerai ou d'un alliage] Qui contient du manganèse. Acier manganésé; fonte manganésée. On donne le nom général de bronze à des alliages spéciaux, à base de cuivre, (...) dont les plus connus sont: Le bronze manganésé contenant 95 parties de cuivre, 4 parties de manganèse, 1 partie d'étain et de fer (HERDNER, Constr. et conduite locomot., t. 1, 1887, p. 84). L'emploi du mélangeur est particulièrement intéressant pour les fontes Thomas qui sont produites à plus basse température et qui ont, par suite, tendance à être plus sulfureuses. Les minerais phosphoreux sont peu manganésés et sans mélangeur, il est au contraire nécessaire de disposer d'un fort pourcentage de manganèse en vue de neutraliser l'effet du soufre (BARNERIAS, Aciéries, 1934, p. 29). — [
, mais ces formes ne conviennent pas du point de vue phonét. (v. FEW t.6, 1, p.198a).DÉR. 1. Manganésé, -ée, adj. [En parlant d'un minerai ou d'un alliage] Qui contient du manganèse. Acier manganésé; fonte manganésée. On donne le nom général de bronze à des alliages spéciaux, à base de cuivre, (...) dont les plus connus sont: Le bronze manganésé contenant 95 parties de cuivre, 4 parties de manganèse, 1 partie d'étain et de fer (HERDNER, Constr. et conduite locomot., t. 1, 1887, p. 84). L'emploi du mélangeur est particulièrement intéressant pour les fontes Thomas qui sont produites à plus basse température et qui ont, par suite, tendance à être plus sulfureuses. Les minerais phosphoreux sont peu manganésés et sans mélangeur, il est au contraire nécessaire de disposer d'un fort pourcentage de manganèse en vue de neutraliser l'effet du soufre (BARNERIAS, Aciéries, 1934, p. 29). — [ ]. — 1re attest. 1873 (Lar. 19e); de manganèse, suff. -é. 2. Manganésien, -ienne, adj. a) Qui contient du manganèse. Le grenat syrien. Spessartine. (...) ainsi nommé à cause de sa présence dans le Spessart en Bavière, est alumino-manganésien (LAPPARENT, Minér., 1899, p. 483). b) ,,Relatif au manganèse`` (ROB.). — [
]. — 1re attest. 1873 (Lar. 19e); de manganèse, suff. -é. 2. Manganésien, -ienne, adj. a) Qui contient du manganèse. Le grenat syrien. Spessartine. (...) ainsi nommé à cause de sa présence dans le Spessart en Bavière, est alumino-manganésien (LAPPARENT, Minér., 1899, p. 483). b) ,,Relatif au manganèse`` (ROB.). — [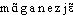 ], fém. [-
], fém. [-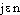 ]. —1re attest. 1840 (Ac. Compl. 1842); de manganèse, suff. -ien. 3. Manganésifère, manganifère, adj. Synon. de manganésé, manganésien. Un haut-fourneau au coke produit en moyenne 23000 tonnes de fonte par année, dans notre département [la Meurthe-et-Moselle]. Dans certains d'entre eux on ajoute du minerai de manganèse pour fabriquer des fontes manganésifères pour aciéries (Ch. DURAND, Industr. minér., 1893, p. 49). Même dans les mélanges mécaniques des wads ferrifères et des limonites manganifères on observe très souvent la même prépondérance de l'un de ces composés (VERNADSKY, Géochim., 1924, p. 83). — [
]. —1re attest. 1840 (Ac. Compl. 1842); de manganèse, suff. -ien. 3. Manganésifère, manganifère, adj. Synon. de manganésé, manganésien. Un haut-fourneau au coke produit en moyenne 23000 tonnes de fonte par année, dans notre département [la Meurthe-et-Moselle]. Dans certains d'entre eux on ajoute du minerai de manganèse pour fabriquer des fontes manganésifères pour aciéries (Ch. DURAND, Industr. minér., 1893, p. 49). Même dans les mélanges mécaniques des wads ferrifères et des limonites manganifères on observe très souvent la même prépondérance de l'un de ces composés (VERNADSKY, Géochim., 1924, p. 83). — [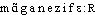 ], [-
], [-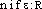 ]. — 1re attest. a) 1840 manganésifère (Ac. Compl. 1842); b) 1924 manganifère, supra; de manganèse et de l'élém. -fère. BBG. — HOPE 1971, p. 208. — QUEM. DDL t. 3 (s.v. manganeux); 18 (s.v. manganisme).manganèse [mɑ̃ganɛz] n. m.ÉTYM. 1774; « magnésie noire », 1578; nom anc. du peroxyde de manganèse; ital. manganesa, p.-ê. altér. de magnesia.❖♦ Corps simple, métal d'un blanc grisâtre (symb. Mn), dur et cassant, de densité 7,2 fondant à 1 240° (no at. 25). || Le manganèse existe dans le sol à l'état d'oxyde (acerdèse, braunite, haussmannite), de bioxyde (pyrolusite) ou de sulfures (alabandine). || Acier, bronze au manganèse, ferromanganèse (→ le préf. Ferro-). || Emploi du sulfate de manganèse comme engrais. || Nodules de manganèse trouvés au fond des océans.❖DÉR. et COMP. Manganate, manganésien, manganeux, manganifère, manganin, manganique, manganisme, manganite.
]. — 1re attest. a) 1840 manganésifère (Ac. Compl. 1842); b) 1924 manganifère, supra; de manganèse et de l'élém. -fère. BBG. — HOPE 1971, p. 208. — QUEM. DDL t. 3 (s.v. manganeux); 18 (s.v. manganisme).manganèse [mɑ̃ganɛz] n. m.ÉTYM. 1774; « magnésie noire », 1578; nom anc. du peroxyde de manganèse; ital. manganesa, p.-ê. altér. de magnesia.❖♦ Corps simple, métal d'un blanc grisâtre (symb. Mn), dur et cassant, de densité 7,2 fondant à 1 240° (no at. 25). || Le manganèse existe dans le sol à l'état d'oxyde (acerdèse, braunite, haussmannite), de bioxyde (pyrolusite) ou de sulfures (alabandine). || Acier, bronze au manganèse, ferromanganèse (→ le préf. Ferro-). || Emploi du sulfate de manganèse comme engrais. || Nodules de manganèse trouvés au fond des océans.❖DÉR. et COMP. Manganate, manganésien, manganeux, manganifère, manganin, manganique, manganisme, manganite.
Encyclopédie Universelle. 2012.
